
Ungefähr mit der Einführung erster Lockerungen nach dem SARS-CoV-2-Pandemie bedingten Shutdown in Deutschland tritt eine in Sachen Digitalisierung wegweisende Verordnung am 21.04.2020 in Kraft: die Digitale Gesundheitsanwendungsverordnung (DiGAV). Die DiGAV ist quasi wegweisend um die Digitale Gesundheitsanwendung (DiGA) in das Verzeichnis der erstattungsfähigen DiGAs (der gesetzlichen Krankenversicherung) aufzunehmen. Die DiGAV gibt den Rahmen für das Verfahren, die Anforderungen zur Prüfung und den Inhalt des Antrags vor. Seit dem 05.05.2020 ist das Antragsverfahren beim BfArM (1) verfügbar und online. Wir wollen hier eine Bestandsaufnahme der ersten 100 Tage seit dem Start des Antragsverfahrens machen, erklären kurz nochmal was eine DiGA definiert und haben mit ein paar Unternehmerinnen und Unternehmern sprechen können die ihre DiGA bereits im Verzeichnis haben.
Eine DiGA ist eine Software-Anwendung (App oder Browser gestützt) die in ihrer digitalen Hauptfunktion eine Krankheit, Verletzung oder Behinderung erkennt, überwacht oder lindert und somit Unterstützung in der Behandlung bietet[2]. Die digitale Hauptfunktion wird maßgeblich aus der Zweckbestimmung und den Angaben des Herstellers (Gebrauchsanweisung, Werbematerial) bestimmt und es sollte ersichtlich sein, dass dieser medizinische Zweck wesentlich durch die digitale Hauptfunktion erreicht wird. Weiterhin ist klar, dass für die DiGA ein positiver Versorgungseffekt (pVE) nachgewiesen ist und somit die Leistung direkt dem Patienten zu ute kommt und dieser muss der/die hauptsächliche Anwender/in sein. Abbildung 1 zeigt graphisch was eine DiGA definiert.
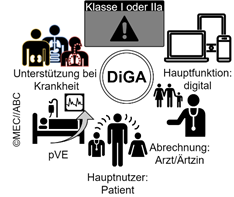
Abbildung 1. Die DiGA ist eine Software-Anwendung der Risikoklasse I oder IIa und hat einen positiven Versorgungseffekt und Unterstützt bei z.B. einer Erkrankung. Dies wird durch eine digitale Hauptfunktion der DiGA hervorgerufen.
DiGA Antrag und das Verfahren – Statusreport
Durch das Fast-Track Verfahren des BfArM wird die Möglichkeit gegeben bei entsprechenden Voraussetzungen die DiGA nach spätestens 3 Monaten in das Verzeichnis für erstattungsfähige DiGAs aufzunehmen. Das ermöglicht vielen Herstellern von digitalen Gesundheitslösungen eine schnelle Chance ihr sicheres und leistungsfähiges Produkt als Medizinprodukt auf den Markt zu bringen. Das kommt auch dem Patienten und dem Gesundheitssystem zugute, da die DiGA positive Versorgungseffekte erzielen muss. Doch ist der Weg der DiGA in das Verzeichnis wirklich so einfach? Auf der Seite des Spitzenverbands Digitale Gesundheitsversorgung e.V. (Stand September 2020) sind zur Zeit 15 Digitale Gesundheitsanwendungen[3] gelistet. Die hier aufgelisteten DiGAs sind eine Reihe SmartPhone/Tablet Apps oder Browser-Applikationen und manche davon sind schon vor der Einführung der Digitale Gesundheitsverordnung (DGV) auf dem Markt präsent. Letztlich haben es immerhin schon 15 Unternehmerinnen und Unternehmer geschafft ihre DiGA Vision verfügbar zu machen. Ende Juli lagen 18 Anträge vor[4], die Hälfte davon zur vorläufigen Aufnahme in das DiGA-Verzeichnis. Das ist eine gute Quote. Allerdings ist noch für keine DiGA die Zulassung erteilt worden (Stand 28.08.2020). Die ersten Zulassungen werden für Herbst 2020 erwartet. Dennoch haben die Unternehmerinnen und Unternehmer hier die ersten Hürden zum Zulassungsverfahren für ihre DiGA genommen. Wie haben sie die Prozedur empfunden? Alle Unternehmerinnen und Unternehmer von denen die MEC//ABC eine Rückmeldung zur Frage des regulatorischen Aufwands erhalten hatten, gaben an, dass dieser groß bis sehr groß war. In allen Fällen wurde Hilfe bei der Erstellung der Unterlagen wie zum Beispiel die Konformitätserklärung für die CE-Zertifizierung, und die Vorbereitungen zum DiGA Antrag angefordert. Insbesondere das Evaluationskonzept ist nicht zu unterschätzen und benötigt zudem die Beauftragung einer unabhängigen Institution. Vor dem Antrag ist es deshalb zunächst Ratsam die Eignung der DiGA zu prüfen, eine Konformitätserklärung (CE-Zertifizierung) abgeschlossen (besonders für DiGA mit Risikoklasse IIa da hier eine Benannte Stelle mit einbezogen werden muss) und das Evaluationskonzept erstellt zu haben. Es sollten zudem alle Informationen, Dokumente, Studienergebnisse nach §§ 10- 12 DiGAV bzw. relevante Daten nach § 14 DiGAV[5] gesammelt und zentralisiert werden – so lässt sich schneller und leichter während des Antrags die Abfragen und Checklisten in den Anlagen 1 und 2 bearbeiten.
Die Hilfestellungen seitens des BfArM zum Antrag sind positiv – so die Rückmeldungen und unsere eigenen Erfahrungen. So gibt es einen guten Einstieg in das Thema schon auf der BfArM Webseite[6] und einen gut lesbaren Leitfaden[7] sowie eine Ausfüllhilfe[8] zum Antragsverfahren. Das Feedback und die Beratung durch das BfArM kann auch als positiv bewertet werden, denn es gibt ein Beratungskonzept (seit Mai hat das BfArM 50 Beratungen durchgeführt) und auch eine schnelle (in der Regel innerhalb 1 – 2 Tage), kostenfreie Hilfe bei kleineren Anfragen z.B. per eMail[9].
Allerdings ist es wichtig die Tragweite zu verstehen, dass bei der Entscheidung seine DiGA als Medizinprodukt anerkennen zu lassen und in das Verzeichnis der erstattungsfähigen DiGAs aufnehmen zu lassen, die regulatorischen Anforderungen und Medizinprodukte Richtlinien zum tragen kommen: das heißt, selbst eine DiGA der Risikoklasse I muss den regulatorischen Anforderungen genügen, obwohl es manchmal „eine viel zu hohe Anforderungen darstellt für diese Art von DiGA“ – so einer der Unternehmer. Denn die Anforderungen nach MDR, CE-Zertifizierung, §§ 3-6 DiGAV, Evaluationskonzept, Studiendurchführung usw. zu erfüllen kostet Zeit und Geld. Jedenfalls muss das bei der Entscheidung die digitale Anwendung zu einer DiGA als Medizinprodukt zu zulassen dringend mit einkalkuliert werden. Insbesondere für den Nachweis der positiven Versorgungseffekte (pVE) muss man genauer hinschauen: es muss mindestens eine retrospektive Studie vorliegen die den pVE nachweist, gibt es noch keine Studien müssen ausreichend relevante Daten systematisch ausgewertet, daraus eine plausible Begründung verfasst und ein Evaluationskonzept erstellt werden. Aus dem Evaluationskonzept muss hervorgehen, wie der Nachweis der pVE erfolgen wird. Ist diese Hürde zusammen mit einer erfolgreichen Evaluierung seitens des BfArM geschafft, wird die DiGA vorläufig in das Verzeichnis aufgenommen und dem Hersteller verbleiben 12 Monaten (ggf. mit Verlängerung um 12 weitere Monate) um ausreichend Daten über eine prospektive Studie zu sammeln. Die Art der Studie ist hierbei ebenfalls entscheidend, allerdings kann im Rahmen dieses Beitrags hierauf nicht näher eingegangen werden. Allerdings ist es zu empfehlen sich hier Hilfe zu holen. Klärungsbedarf gibt es auch noch bei manchen Text-Formulierungen wie beispielsweise im DiGA-Leitfaden: „…Dieses [Evaluationskonzept] muss von einem herstellerunabhängigen wissenschaftlichen Institut erstellt worden sein.“ Hier wurde dann die Frage gestellt was ein „Institut“ genau ist, denn der Begriff ist nicht geschützt – doch im allgemeinen Sprachgebrauch verbindet man meistens damit öffentliche oder halb-staatliche Organisationen im wissenschaftlichen Bereich. Doch das BfArM hat auf diese Frage reagiert und erklärt, dass es einfach eine vom Hersteller unabhängige dritte Partei sein muss.
Die meisten der Unternehmer und Unternehmerinnen mit denen wir sprachen hatten eine Beratung durch das BfArM sowie Unterstützung (insbesondere für die CE-Zertifizierung und das Evaluationskonzept) durch Beratungsunternehmen wie die MEC//ABC. Wenn Sie Hilfe benötigen zum Beispiel bei der Konformitätserklärung nach MDR (oder ggf. MDD) oder beim Nachweis der positiven Versorgungseffekte oder für den Antrag und die Antragsstellung, dann kontaktieren Sie uns gerne unter: info@mec-abc.de
MEC-ABC GmbH
Aachener-und-Münchener-Allee 9
52074 Aachen
Tel.: +49 241-51967486
Mail: info@mec-abc.de
Die MDR ist nach einer vierjährigen Übergangszeit, ab dem 26. Mai 2021 verpflichtend anzuwenden.
Nutzen Sie unseren kostenlosen Newsletter rund um die Zertifizierung von Medizinprodukten unter MDR.
Bleiben Sie informiert.
Ihre hier eingegebenen Daten werden lediglich zur Personalisierung des Newsletters verwendet und nicht an Dritte weitergegeben. Sie können sich jederzeit aus dem Newsletter heraus abmelden oder Ihre Einwilligung jederzeit per E-Mail an info@mec-abc.de widerrufen. Ihre Daten werden nach Beendigung des Newsletter-Empfangs innerhalb von 1 Monat gelöscht, sofern der Löschung keine gesetzlichen Aufbewahrungspflichten entgegenstehen. Durch Absenden der von Ihnen eingegebenen Daten willigen Sie in die Datenverarbeitung ein und bestätigen unsere Datenschutzerklärung.
Sollte die Mail nicht in Ihrem Posteingang zu finden sein, kontrollieren Sie bitte auch Ihren Spamordner.
Das Template-Paket Klinische Bewertung ist für Sie jetzt zum Angebotspreis in limitierter Auflage verfügbar.
Sichern Sie sich unsere Whitepaper zu “Anforderungen der MDR” und “Übersicht über die Konformitäts-Bewertungsverfahren”.
Sie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Facebook. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Instagram. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Google Maps. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Turnstile. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von X. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr Informationen